
Back Selbstorganisierende Monoschicht German Αυτοσυναρμολογούμενες μονοστιβάδες Greek Self-assembled monolayer English تک لایههای خودآرا Persian Monostrato auto-assemblato Italian 自己組織化単分子膜 Japanese Самособирающиеся монослои Russian
Las monocapas autoensambladas (también conocidas por la sigla en inglés SAM) son agrupaciones espontáneas de moléculas orgánicas formadas por adsorción sobre superficies y organizadas en dominios ordenados más o menos amplios.[1][2] En algunos casos, las moléculas que forman la monocapa no interactúan fuertemente con el sustrato. Este es el caso, por ejemplo, de las redes supramoleculares bidimensionales[3] de, por ejemplo, dianhídrido perilentetracarboxílico sobre oro[4] o de porfirinas sobre grafito pirolítico altamente orientado.[5] En otros casos, las moléculas poseen un grupo de cabeza o ligando con alta afinidad por el sustrato por el que se adhieren a él; tioles, silanos y fosfonatos están entre los ligandos comunes.
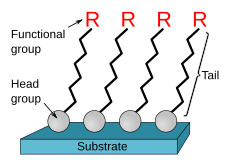
La formación de monocapas autoensambladas se inicia mediante la quimisorción de los ligandos a un sustrato desde la fase de vapor o líquida,[6][7] seguida por una organización lenta de los grupos de cola.[8] Al comienzo, cuando la densidad molecular en la superficie es baja, las moléculas de adsorbato forman una masa desordenada o forman una «fase tumbada» bidimensional ordenada;[6] al aumentar la cobertura de la superficie, durante un período de minutos a horas, comienzan a formarse estructuras cristalinas o semicristalinas tridimensionales en la superficie del sustrato.[9] Los grupos de cabeza se disponen sobre el sustrato, mientras que los grupos de cola se orientan lejos de la superficie. Las áreas de moléculas compactas forman núcleos que crecen hasta que la superficie del sustrato se cubre con una sola monocapa.
Las moléculas de adsorbato reducen la energía libre superficial del sustrato[1] y son estables debido a la fuerte quimisorción de los ligandos. Las monocapas resultantes son más estables que los enlaces fisisorbidos de las películas de Langmuir-Blodgett.[10][11] Un ligando basado en triclorosilano, como el de la molécula de FDTS, reacciona con un grupo hidroxilo en un sustrato y forma un enlace covalente muy estable [sustrato R-Si-O] con una energía de 452 kJ/mol. Los enlaces tiol-metal son del orden de 100 kJ/mol, lo que los hace bastante estables en una variedad de temperaturas, solventes y voltajes.[9] La monocapa se empaqueta fuertemente debido a interacciones de van der Waals,[1][11] lo que reduce su propia energía libre.[1] La adsorción puede describirse mediante la isoterma de adsorción de Langmuir si no se tienen en cuenta las interacciones laterales; si estas no son negligibles, la adsorción se describe mejor mediante la isoterma de Frumkin.[9]
- ↑ a b c d Love et al. (2005). «Self-Assembled Monolayers of Thiolates on Metals as a Form of Nanotechnology». Chem. Rev. (en inglés) 105 (4): 1103-1170. PMID 15826011. doi:10.1021/cr0300789.
- ↑ Barlow, S.M.; Raval R.. (2003). «Complex organic molecules at metal surfaces: bonding, organisation and chirality». Surface Science Reports (en inglés) 50 (6–8): 201-341. Bibcode:2003SurSR..50..201B. doi:10.1016/S0167-5729(03)00015-3.
- ↑ Elemans, J.A.A.W.; Lei S., De Feyter S. (2009). «Molecular and Supramolecular Networks on Surfaces: From Two-Dimensional Crystal Engineering to Reactivity». Angew. Chem. Int. Ed. (en inglés) 48 (40): 7298-7332. PMID 19746490. doi:10.1002/anie.200806339.
- ↑ Witte, G.; Wöll Ch. (2004). «Growth of aromatic molecules on solid substrates for applications in organic electronics». Journal of Materials Research (en inglés) 19 (7): 1889-1916. Bibcode:2004JMatR..19.1889W. doi:10.1557/JMR.2004.0251.
- ↑ De Feyter, S.; De Schreyer F.C. (2003). «Two-dimensional supramolecular self-assembly probed by scanning tunneling microscopy». Chemical Society Reviews (en inglés) 32 (3): 139-150. PMID 12792937. doi:10.1039/b206566p.
- ↑ a b Schwartz, D.K., Mechanisms and Kinetics of Self-Assembled Monolayer Formation (2001). «Mechanisms and kinetics of self-assembled monolayer formation». Annu. Rev. Phys. Chem. (en inglés) 52: 107-37. Bibcode:2001ARPC...52..107S. PMID 11326061. doi:10.1146/annurev.physchem.52.1.107.
- ↑ Schreiber, F (30 de noviembre de 2000). «Structure and growth of self-assembling monolayers». Progress in Surface Science (en inglés) 65 (5–8): 151-257. Bibcode:2000PrSS...65..151S. doi:10.1016/S0079-6816(00)00024-1.
- ↑ Wnek, Gary, Gary L. Bowlin (2004). Encyclopedia of Biomaterials and Biomedical Engineering (en inglés). Informa Healthcare. pp. 1331-1333.
- ↑ a b c Vos, Johannes G., Robert J. Forster, Tia E. Keyes (2003). Interfacial Supramolecular Assemblies (en inglés). Wiley. pp. 88-94.
- ↑ Madou, Marc (2002). Fundamentals of Microfabrication: The Science of Miniaturization (en inglés). CRC. pp. 62-63.
- ↑ a b Kaifer, Angel (2001). Supramolecular Electrochemistry. Coral Gables (en inglés). Wiley VCH. pp. 191-193.